Seguro que en abril del 2003 escuchaste la noticia de que se había terminado la secuenciación del genoma humano, que científicos habían logrado definir nuestro código genético y que esto traería muchos beneficios. En efecto, ya hay enfermedades curadas gracias a la terapia génica y con cada investigación mundial en esta técnica, suman y siguen. Parece ficción, pero es ciencia real.
Por Monserrat Quezada / monquezada@udec.cl / Imágenes: Facultad de Ciencias Biológicas
El rápido avance de nuestro conocimiento respecto al origen genético de ciertas enfermedades, a la secuencia y organización del genoma humano, así como respecto a herramientas que permiten manipularlo, han dado lugar a las primeras terapias génicas. Ésta consiste en la introducción de material genético en el interior de un órgano o tejido con la intención de producir un efecto biológico que permita prevenir o tratar una enfermedad. Por lo tanto, abre nuevas posibilidades al tratamiento de diversas patologías, como por ejemplo, la reparación de fracturas, tumores, y la lista es casi tan extensa como nuestra imaginación.
En los últimos años nos hemos visto conmovidos con colectas de dinero para el tratamiento de niños que padecen de atrofia muscular espinal o AME, “patología grave que resulta en la muerte progresiva de neuronas motoras, aquellas que controlan el movimiento coordinado de los músculos. Su origen son mutaciones que resultan en la producción insuficiente o nula de la proteína SMN, imprescindible para la supervivencia de estas neuronas. Felizmente, existe hoy una alternativa de tratamiento de esta enfermedad, a través de la terapia génica”, explica el Dr. Juan Pablo Henríquez de la Facultad de Ciencias Biológicas de la Universidad de Concepción.

Este tratamiento de terapia génica consiste en la inyección de un adenovirus modificado (inofensivo) que, aplicado antes de los dos años de vida, permite reparar el gen SMA deficiente en las neuronas motoras de niños con AME, lo que mejora su movilidad y con ello su calidad de vida. Lamentablemente, se trata de “el medicamento más caro del mundo”, como se ha conocido mediáticamente.
En la UdeC
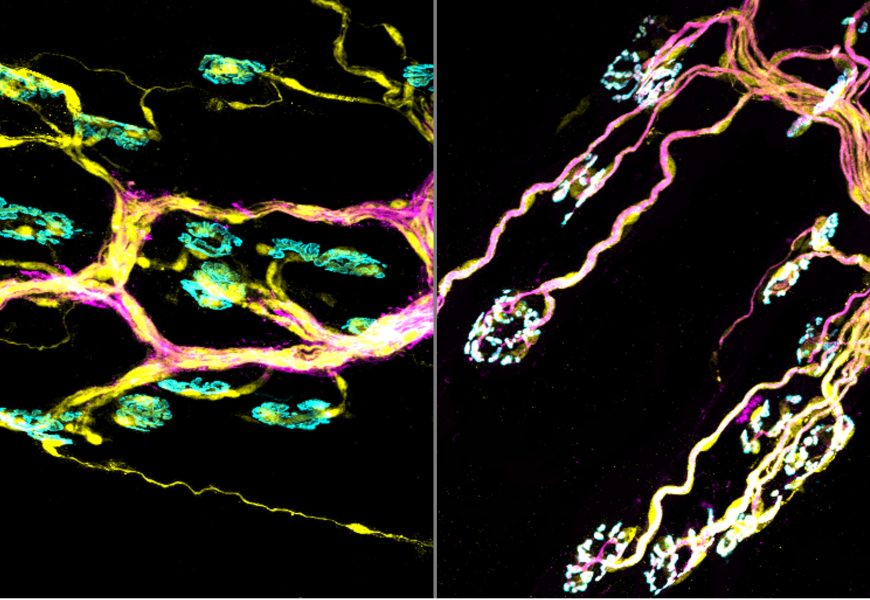
Desde hace más de diez años, el Laboratorio de Estudios Neuromusculares o NeSt Lab UdeC, dirigido por el Dr. Henríquez, se dedica a “modificar la expresión de proteínas en músculos de animales vivos para estudiar el efecto de la expresión o silenciamiento de esas proteínas sobre (en nuestro caso) la sinapsis neuromuscular, la que controla la contracción muscular”, explicó. “Esa aproximación es la misma que se está empleando actualmente en terapia génica frente a enfermedades, concepto que hace veinte años parecía futurista y que ahora está siendo aplicado, por ejemplo en el caso de los niños con AME”.
Particularmente, el trabajo actual del laboratorio, que recientemente ha conseguido financiamiento de Fondecyt por cuatro años, busca revertir algunas de las consecuencias patológicas del envejecimiento sobre los músculos (conocida como sarcopenia) y de la Esclerosis Lateral Amiotrófica, enfermedad conocida por afectar al científico Stephen Hawking y que originó la iniciativa “ice bucket challenge” para alertar sobre la falta de investigación en ella.
La sarcopenia es una condición progresiva y generalizada producto del envejecimiento del sistema músculo-esquelético y que se caracteriza por pérdida de masa, fuerza y función muscular. “Para contraerse, los músculos necesitan un estímulo desde las neuronas motoras (ubicadas en la médula espinal), a través de la llamada sinapsis neuromuscular, la que también sufre alteraciones en la sarcopenia”, afirma. “En este proyecto, manipularemos experimentalmente la actividad de un grupo de proteínas llamadas Wnt en músculos de animales envejecidos con la expectativa de que inhibir las alteraciones de la sinapsis neuromuscular tenga un efecto benéfico en prevenir la sarcopenia. Haremos una aproximación similar en ratones modelo de ELA”, contó Henríquez.
El reto científico actual es producto de una serie de hallazgos obtenidos a través de la línea de estudios que ha seguido Henríquez junto a sus grupos de investigación. Entre los frutos de su postdoctorado que cursó en la University College London (Inglaterra), destaca ser los primeros en publicar que algunas proteínas Wnt podían controlar la formación embrionaria de la sinapsis neuromuscular, conocimiento que han profundizado en el NeSt Lab, identificando proteínas y receptores Wnt que participan en la maduración y estabilización de la sinapsis neuromuscular en adultos. “Esos resultados representan una sólida base para estudiar posibles aplicaciones terapéuticas de usar proteínas Wnt sobre la sarcopenia y patologías motoras”, asevera.
Favorablemente, distintas proteínas Wnt se están probando en ensayos clínicos en otros contextos patológicos, como cáncer.
Last modified: 31 de mayo de 2023“Si demostramos que la terapia génica basada en proteínas Wnt tiene un efecto en prevenir la sarcopenia en animales de experimentación, como anticipamos que sucederá, los impactos sobre la ciencia básica y sus potenciales aplicaciones terapéuticas son enormes. Y está ocurriendo aquí mismo en la Universidad de Concepción”, concluyó.